Abstract. Since UV radiation is so harmful to lupus patients, an understanding of the physics of it is given here.
La “luz” ultravioleta perjudica a los Lúpicos (y no sólo a los lúpicos) Pero ¿por qué? ¿Qué es en realidad? En un artículo anterior situamos la radiación ultravioleta dentro de la radiación solar y dentro del espectro electromagnético (espectro = gama de radiaciones) Vale, pero, ¿en qué consiste todo esto?
La “luz” ultravioleta perjudica a los Lúpicos (y no sólo a los lúpicos) Pero ¿por qué? ¿Qué es en realidad? En un artículo anterior situamos la radiación ultravioleta dentro de la radiación solar y dentro del espectro electromagnético (espectro = gama de radiaciones) Vale, pero, ¿en qué consiste todo esto?
En la Naturaleza existen sólo cuatro clases de fuerzas
fundamentales. Todas las demás son derivaciones de estas. Estas cuatro fuerzas
son: El electromagnetismo (EM), la gravedad, la interacción fuerte y la
interacción débil. La gravedad nos es muy familiar. Las interacciones fuerte y
débil intervienen sólo en física atómica. El EM nos es familiar en muchas de
sus manifestaciones: imanes y electricidad. Y, aunque no resulte evidente, la
luz, la radiación UV, las ondas de radio, etc. son fenómenos electromagnéticos.
El “campo” magnético (la fuerza que ejerce en el espacio un imán) y el campo
eléctrico interactúan. Un campo eléctrico variable genera un campo magnético
que, a su vez, genera un campo eléctrico. Y esto se propaga en el espacio lo
mismo que se propaga en forma de ondas la perturbación que se produce en un estanque
al caer una piedra.
La característica más importante para nosotros es la
longitud de onda l
Por otra parte, en nuestro caso, las ondas se desplazan, viajan, a una velocidad v
El número de crestas que pasan por un punto dado en un segundo
es su frecuencia f
La
frecuencia f la
longitud de onda l y la velocidad v con que se propaga la onda están relacionadas
por la ecuación:
l = v / f
En nuestro caso se trata de ondas electromagnéticas. Estas ondas se propagan a
través del vacío y a través de medios materiales. Cuando se propagan a través
del vacío lo hacen en línea recta y a la misma velocidad, la que conocemos como "velocidad de la luz", que se representa por “c” y que vale c = 299,8 km/s Por eso, la frecuencia
de una radiación electromagnética está relacionada con su longitud de onda por
la ecuación:
l = c / f
Dicho esto, hemos de aclarar que las ondas electromagnéticas son más complejas que lo que hemos descrito. No constan de una onda sola sino de dos superpuestas, perpendiculares entre si y a la dirección de propagación. Una es el campo magnético y la otra el campo eléctrico.
Las radiaciones EM son esencialmente iguales ¿Por qué entonces las distinguimos en ondas de radio, microondas, infrarrojas, luz visible,
ultravioleta, rayos X y rayos gamma? Las distinguimos, no por algo
esencialmente distinto en ellas, sino porque nos afectan a nosotros de
diferente manera dependiendo de su frecuencia. Y porque se comportan de modo diferente en distintos medios
materiales. El siguiente gráfico muestra su clasificación en función de su
frecuencia.
Ya sabemos que, de toda esta gama de frecuencias, del sol
nos llegan las infrarrojas, las visibles y las ultravioleta.
Y ¿Por qué nos afectan de modo diferente según su frecuencia
(o su longitud de onda)? Pues porque nosotros estamos hechos de átomos. Y la
radiación EM afecta a los átomos. Nuestros tejidos están constituidos por
células. Pero las células están, a su vez, compuestas por moléculas y éstas por
átomos.
A principios del siglo XX físicos como Plank, Einstein,
DeBroglie, Thomson, Davisson, (Premios Nobel de Física
1918,1921, 1929, 1937) etc. tuvieron que
rendirse a la evidencia de que las radiaciones tienen un comportamiento dual:
Se comportan tanto como ondas como como partículas. Que se comportan como
partículas quiere decir que un rayo de luz (por ejemplo) podríamos imaginarlo
como un chorro de perdigones (además de ser una onda). Y que,
recíprocamente, un electrón, además de
ser una partícula, se comporta como una onda.
En su aspecto corpuscular la luz se compone de fotones (en
nuestro símil, los perdigones). Y los fotones poseen energía.
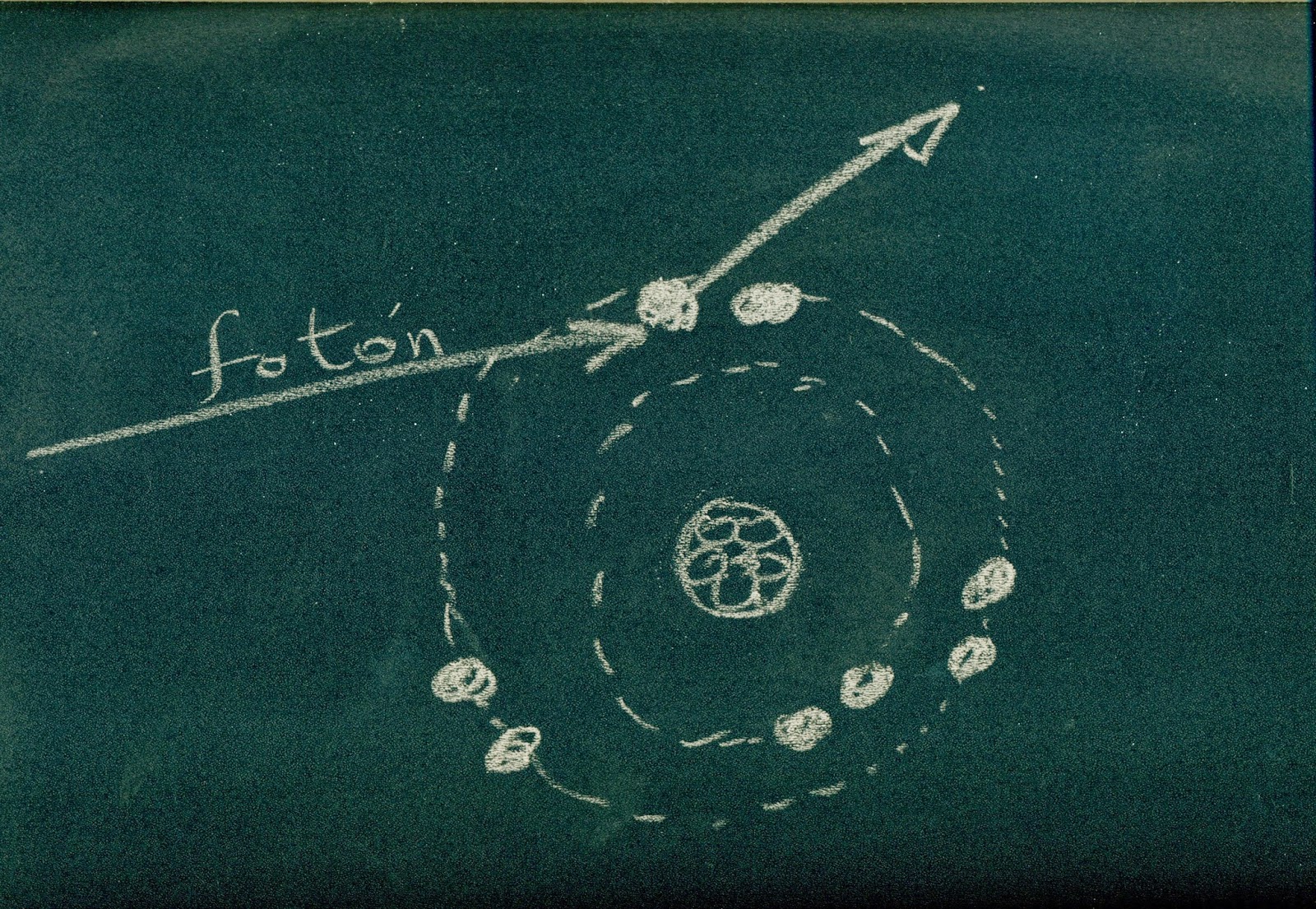
Cuando un fotón incide en un átomo, si posee suficiente
energía, arranca electrones de sus orbitales.
El átomo queda, digamos, desequilibrado, falto de un electrón. Con una carga eléctrica neta positiva. Se denomina un ion (catión en este caso) Un átomo así, ya sea solo o formando parte de una molécula se denomina “radical libre” y tiene una marcada tendencia a combinarse con otro átomo que pueda compensar su falta de un electrón.
La molécula original se combinará con alguna otra. El resultado será que la célula de la que forma parte no funcionará como debe y se alterará el tejido del que forma parte.
Los átomos no son todos iguales, cada elemento de la naturaleza se distingue de los demás por la composición de sus átomos. Hemos representado un átomo de oxígeno, que tiene en el núcleo ocho protones y ocho neutrones. Correspondientemente, tiene ocho electrones situados, dos en la capa s y seis en la capa p. Un átomo de hidrógeno tiene un solo protón y un solo electrón. Un átomo de carbono tiene seis protones y seis electrones, etc. etc.
La energía necesaria para arrancar un electrón no es igual en unos átomos que en otros. La radiación que incide en el átomo arrancará electrones sólo si posee la energía suficiente. Y ¿qué energía posee una radiación?
La energía que posee un fotón depende enteramente de la frecuencia de su onda. A mayor frecuencia (o menor longitud de onda) más energía. Más exactamente
E (energía) = h . f
o, lo que es lo mismo:
E = h . c / l
E está expresado en J (joules), c es la velociad de la luz en km/s, l la longitud de onda en metros, f la frecuencia en herzios y h la denominada "Constante de Planck" que vale 6,6 x 10-34
Por lo tanto, a medida que aumenta la frecuencia de una
radiación aumenta en la misma proporción la energía de los fotones que la
componen.
A frecuencias bajas la radiación no posee suficiente energía
para ionizar átomos (arrancarles electrones) Son radiaciones “no ionizantes”
Pero a medida que aumenta la frecuencia llega un punto en que ya posee
suficiente energía. Estas son “radiaciones ionizantes” Este punto empieza en la
radiación UV
Resumiendo, las radiaciones que llegan a nuestra piel
consisten en fotones que chocan con los átomos de nuestras células. Si tienen
suficiente energía arrancan electrones a los átomos y las células funcionan
mal.
Las radiaciones de frecuencias más bajas que las de la ultravioleta no
tienen suficiente energía para afectar nuestros átomos. Como hemos dicho,
la energía de una radiación está en proporción directa a su frecuencia. La
radiación UV tiene frecuencias mayores (= menores longitudes de onda) que la
luz visible y, por lo tanto, más energía. La suficiente para ionizar (arrancar
electrones) a algunos átomos.
Asimismo, las radiaciones de longitudes de onda aún más
bajas que las de la UV tienen también más energía. Por ejemplo los rayos X y
los gamma (g). Afortunadamente, ni unos ni otros nos llegan del sol. Los rayos X
tienen alta energía y por eso se nos aplican sólo cuando es necesario y durante
el tiempo brevísimo de una radiografía.
Los rayos gamma (g) proceden de reacciones atómicas nucleares.
Se producen en fenómenos astrofísicos y no nos llegan a nosotros porque son absorbidas
por la atmósfera. A nivel del suelo hay algunos elementos naturales que las
producen, si bien en cantidades muy pequeñas.
(También las producen las bombas atómicas…..)
Resumiendo, la radiación UV tiene de particular que es la
única parte de la radiación que nos llega del sol que posee suficiente energía
para ionizar los átomos de nuestras células.
No se produce sólo en el sol. En la tierra tenemos otras
fuentes de radiación UV. Los arcos de soldadura, por ejemplo, las lámparas
especiales, lámparas fluorescentes y de bajo consumo.
El caso de las lámparas fluorescentes y de bajo consumo es
interesante porque las usamos en gran cantidad. En estas lámparas se produce
radiación UV que choca con el recubrimiento
del interior del tubo y se convierte enteramente en luz visible. No sale
radiación UV al exterior…a menos que el tubo esté en malas condiciones o sea de
mala calidad…
La radiación UV tiene
longitudes de onda comprendidas entre 400nm y 100nm (nm = nanómetro = 1
millonésima de milímetro) y sus fotones tienen energías de 3,10 a 10,4 eV (eV =
electrón-voltio = la energía necesaria para mover un electrón en una diferencia
de potencial de un voltio = 1.6 x 10-19 J)
Para usos prácticos la gama de radiaciones UV se divide de varias maneras.
La más conocida es en:
Denominación
|
Nombre común
|
Rango de longitudes de onda
|
Observaciones
|
Ultravioleta A
|
Rayos UVA
|
De 400 a 315nm
|
No es absorbida por la atmósfera, nos llega casi por entero
|
Ultravioleta B
|
Rayos UVB
|
De 315 a 280nm
|
Absorbida en gran parte pero no del todo por la atmósfera
|
Ultravioleta C
|
Rayos UVC
|
De 280 a 100nm
|
Totalmente absorbida por la atmósfera
|
Ahora ya tenemos una idea del porqué la radiación
ultravioleta es la única parte de la radiación que nos llega del sol que altera
los átomos de nuestro cuerpo. Y por esto
nos tenemos que proteger de los UVA y de los UVB
JLG

Radiación Ultravioleta por JLGaillard se distribuye bajo una Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional.
Basada en una obra en www.lupiossol.blogspot.com.






No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.